
中國(guó)醫(yī)療器械 UDI 規則正式發布
- 分(fēn)類:行業動态
- 作(zuò)者:
- 來源:
- 發布時間:2019-09-03
- 訪問量:0
【概要描述】醫(yī)療器械實施唯一标識/UDI監管制度,經過長(cháng)時間的公開讨論和征求意見,在8月27日國(guó)家藥監局組織的專題會議上正式對外公布。UDI規則自2019年10月1日起施行。
中國(guó)醫(yī)療器械 UDI 規則正式發布
【概要描述】醫(yī)療器械實施唯一标識/UDI監管制度,經過長(cháng)時間的公開讨論和征求意見,在8月27日國(guó)家藥監局組織的專題會議上正式對外公布。UDI規則自2019年10月1日起施行。
- 分(fēn)類:行業動态
- 作(zuò)者:
- 來源:
- 發布時間:2019-09-03
- 訪問量:0
醫(yī)療器械實施唯一标識/UDI監管制度,經過長(cháng)時間的公開讨論和征求意見,在8月27日國(guó)家藥監局組織的專題會議上正式對外公布。UDI規則自2019年10月1日起施行。

為(wèi)貫徹落實《國(guó)務(wù)院辦公廳關于印發治理(lǐ)高值醫(yī)用(yòng)耗材改革方案的通知》(國(guó)辦發〔2019〕37号),規範醫(yī)療器械唯一标識系統建設,加強醫(yī)療器械全生命周期管理(lǐ),依據《醫(yī)療器械監督管理(lǐ)條例》,國(guó)家藥監局制定了《醫(yī)療器械唯一标識系統規則》,現予發布,自2019年10月1日起施行。
特此公告。
附件:醫(yī)療器械唯一标識系統規則
國(guó)家藥監局
2019年8月23日
附件:醫(yī)療器械唯一标識系統規則
第一條 為(wèi)規範醫(yī)療器械唯一标識系統建設,加強醫(yī)療器械全生命周期管理(lǐ),根據《醫(yī)療器械監督管理(lǐ)條例》,制定本規則。
第二條 在中華人民(mín)共和國(guó)境内銷售、使用(yòng)的醫(yī)療器械,其唯一标識系統應當符合本規則。
第三條 本規則所稱醫(yī)療器械唯一标識系統,由醫(yī)療器械唯一标識、唯一标識數據載體(tǐ)和唯一标識數據庫組成。
醫(yī)療器械唯一标識,是指在醫(yī)療器械産品或者包裝(zhuāng)上附載的,由數字、字母或者符号組成的代碼,用(yòng)于對醫(yī)療器械進行唯一性識别。
醫(yī)療器械唯一标識數據載體(tǐ),是指存儲或者傳輸醫(yī)療器械唯一标識的數據媒介。
醫(yī)療器械唯一标識數據庫,是指儲存醫(yī)療器械唯一标識的産品标識與關聯信息的數據庫。
第四條 醫(yī)療器械唯一标識系統建設應當積極借鑒國(guó)際标準,遵循政府引導、企業落實、統籌推進、分(fēn)步實施的原則。
第五條 國(guó)家藥品監督管理(lǐ)局負責建立醫(yī)療器械唯一标識系統制度,制定醫(yī)療器械唯一标識系統建設規劃,推動各方積極應用(yòng)醫(yī)療器械唯一标識,促進醫(yī)療器械全生命周期管理(lǐ)。
省、自治區(qū)、直轄市藥品監督管理(lǐ)部門負責指導并監督本行政區(qū)域内注冊人/備案人開展醫(yī)療器械唯一标識系統建設相關工作(zuò)。
第六條 注冊人/備案人負責按照本規則創建和維護醫(yī)療器械唯一标識,在産品或者包裝(zhuāng)上賦予醫(yī)療器械唯一标識數據載體(tǐ),上傳相關數據,利用(yòng)醫(yī)療器械唯一标識加強産品全過程管理(lǐ)。
鼓勵醫(yī)療器械生産經營企業和使用(yòng)單位積極應用(yòng)醫(yī)療器械唯一标識進行相關管理(lǐ)。
第七條 醫(yī)療器械唯一标識包括産品标識和生産标識。産品标識為(wèi)識别注冊人/備案人、醫(yī)療器械型号規格和包裝(zhuāng)的唯一代碼;生産标識由醫(yī)療器械生産過程相關信息的代碼組成,根據監管和實際應用(yòng)需求,可(kě)包含醫(yī)療器械序列号、生産批号、生産日期、失效日期等。
産品發生可(kě)能(néng)影響醫(yī)療器械識别、追溯的變更或者監管要求變化時,應當創建新(xīn)的産品标識。
醫(yī)療器械停止銷售、使用(yòng)的,其産品标識不得用(yòng)于其他(tā)醫(yī)療器械;重新(xīn)銷售、使用(yòng)時,可(kě)使用(yòng)原産品标識。
第八條 醫(yī)療器械唯一标識應當符合唯一性、穩定性和可(kě)擴展性的要求。
唯一性,是指醫(yī)療器械唯一标識應當與醫(yī)療器械識别要求相一緻。
穩定性,是指醫(yī)療器械唯一标識應當與産品基本特征相關,産品的基本特征未變化的,産品标識應當保持不變。
可(kě)擴展性,是指醫(yī)療器械唯一标識應當與監管要求和實際應用(yòng)不斷發展相适應。
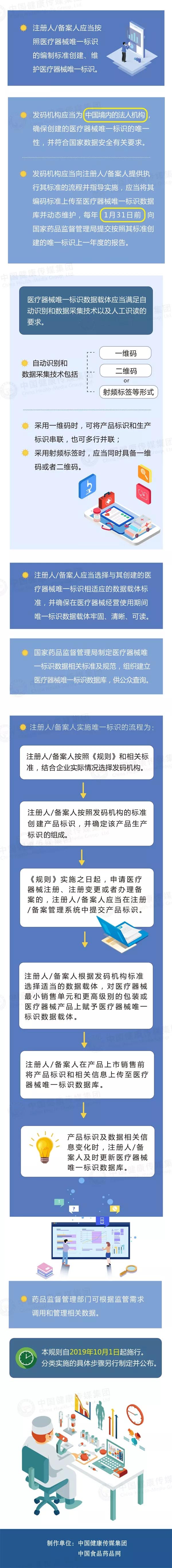
第九條 注冊人/備案人應當按照醫(yī)療器械唯一标識的編制标準創建、維護醫(yī)療器械唯一标識。
醫(yī)療器械唯一标識編制标準應當符合國(guó)家藥品監督管理(lǐ)局以及符合本規則要求的發碼機構制定的相關标準。
第十條 發碼機構應當為(wèi)中國(guó)境内的法人機構,具備完善的管理(lǐ)制度和運行體(tǐ)系,确保按照其标準創建的醫(yī)療器械唯一标識的唯一性,并符合國(guó)家數據安(ān)全有關要求。
發碼機構應當向注冊人/備案人提供執行其标準的流程并指導實施,應當将其編碼标準上傳至醫(yī)療器械唯一标識數據庫并動态維護,每年1月31日前向國(guó)家藥品監督管理(lǐ)局提交按照其标準創建的唯一标識上一年度的報告。
國(guó)家鼓勵發碼機構采用(yòng)相關國(guó)際标準建立唯一标識運行體(tǐ)系。
第十一條 醫(yī)療器械唯一标識數據載體(tǐ)應當滿足自動識别和數據采集技(jì )術以及人工識讀的要求。如空間有限或者使用(yòng)受限,應當優先采用(yòng)符合自動識别和數據采集技(jì )術的載體(tǐ)形式。
自動識别和數據采集技(jì )術包括一維碼、二維碼或者射頻标簽等形式,鼓勵采用(yòng)先進的自動識别和數據采集技(jì )術。
采用(yòng)一維碼時,可(kě)将産品标識和生産标識串聯,也可(kě)多(duō)行并聯;采用(yòng)射頻标簽時,應當同時具備一維碼或者二維碼。
第十二條 注冊人/備案人應當選擇與其創建的醫(yī)療器械唯一标識相适應的數據載體(tǐ)标準,對以其名義上市的醫(yī)療器械最小(xiǎo)銷售單元和更高級别的包裝(zhuāng)或者醫(yī)療器械産品上賦予唯一标識數據載體(tǐ),并确保在醫(yī)療器械經營使用(yòng)期間唯一标識數據載體(tǐ)牢固、清晰、可(kě)讀。
第十三條 國(guó)家藥品監督管理(lǐ)局制定醫(yī)療器械唯一标識數據相關标準及規範,組織建立醫(yī)療器械唯一标識數據庫,供公衆查詢。
第十四條 注冊人/備案人應當按照相關标準或者規範要求上傳、維護和更新(xīn)唯一标識數據庫中的相關數據,并對數據的真實性、準确性、完整性負責。
第十五條 注冊人/備案人應當在申請醫(yī)療器械注冊、注冊變更或者辦理(lǐ)備案時,在注冊/備案管理(lǐ)系統中提交其産品标識。
注冊人/備案人應當在産品上市銷售前,将産品标識和相關數據上傳至醫(yī)療器械唯一标識數據庫。
第十六條 藥品監督管理(lǐ)部門可(kě)根據監管需求調用(yòng)和管理(lǐ)相關數據。
鼓勵各相關方采用(yòng)先進信息化手段、應用(yòng)醫(yī)療器械唯一标識,對醫(yī)療器械在生産、經營、使用(yòng)等環節進行管理(lǐ)。
第十七條 本規則下列用(yòng)語的含義:
自動識别和數據采集,是指不通過鍵盤直接将數據輸入計算機系統或者其他(tā)微處理(lǐ)器控制的設備的技(jì )術。
人工識讀,是指與機器識讀媒介相對應的,可(kě)由人眼直接識别的編碼信息。
第十八條 本規則自2019年10月1日起施行。分(fēn)類實施的具體(tǐ)步驟另行制定并公布。
《醫(yī)療器械唯一标識系統規則》解讀
一、什麽是醫(yī)療器械唯一标識?
醫(yī)療器械唯一标識由産品标識和生産标識組成,産品标識是識别注冊人/備案人、醫(yī)療器械型号規格和包裝(zhuāng)的唯一代碼,是從數據庫獲取醫(yī)療器械相關信息的“關鍵字”,是唯一标識的必須部分(fēn);生産标識包括與生産過程相關的信息,包括産品批号、序列号、生産日期和失效日期等,可(kě)與産品标識聯合使用(yòng),滿足醫(yī)療器械流通和使用(yòng)環節精(jīng)細化識别和記錄的需求。
唯一标識具備唯一性、穩定性和可(kě)擴展性的原則。唯一性是首要原則,是确保産品精(jīng)确識别的基礎,是唯一标識發揮功能(néng)的核心原則。由于醫(yī)療器械産品的複雜性,唯一性應當與産品識别要求相一緻,對于相同特征的醫(yī)療器械,唯一性應當指向單個規格型号産品;對于按照批次生産控制的産品,唯一性指向同批次産品;而對于采用(yòng)序列号生産控制的醫(yī)療器械,唯一性應當指向單個産品。
穩定性是指唯一标識一旦分(fēn)配給醫(yī)療器械産品,隻要其基本特征沒有發生變化,産品标識就應該保持不變。當醫(yī)療器械停止銷售、使用(yòng)時,其産品标識不得用(yòng)于其他(tā)醫(yī)療器械;重新(xīn)銷售、使用(yòng)時,可(kě)使用(yòng)原産品标識。
可(kě)擴展性是指唯一标識應當與監管要求和實際應用(yòng)不斷發展相适應,“唯一”一詞并不意味着對單個産品進行序列号化管理(lǐ),在唯一标識中,生産标識可(kě)以和産品标識聯合使用(yòng),實現規格型号、批次和單個産品三個層次的唯一性,從而滿足當前和未來對醫(yī)療器械的識别需求。
二、為(wèi)什麽要建設醫(yī)療器械唯一标識系統?
醫(yī)療技(jì )術、藥品、醫(yī)療器械是構成醫(yī)療服務(wù)體(tǐ)系的三大支柱,醫(yī)療器械涉及聲、光、電(diàn)、磁、圖像、材料、力學(xué)等行業和近百個專業學(xué)科(kē),是國(guó)際公認的高新(xīn)技(jì )術産業,具有高技(jì )術密集、學(xué)科(kē)交叉廣泛、技(jì )術集成融合等特點,代表着一個國(guó)家高新(xīn)技(jì )術的綜合實力。近年來,醫(yī)療器械産業發展迅猛,新(xīn)技(jì )術、新(xīn)産品層出不窮,産品多(duō)樣性、複雜性程度不斷提升,醫(yī)療器械在流通使用(yòng)環節無碼或者一物(wù)多(duō)碼現象普遍,嚴重影響了醫(yī)療器械生産、流通、使用(yòng)等各環節對醫(yī)療器械的精(jīng)準識别,難以實現有效監督和管理(lǐ)。
醫(yī)療器械唯一标識(Unique Device Identification,簡稱UDI)是醫(yī)療器械的身份證,醫(yī)療器械唯一标識系統由醫(yī)療器械唯一标識、數據載體(tǐ)和數據庫組成。為(wèi)每個醫(yī)療器械賦予身份證,實現生産、經營、使用(yòng)各環節的透明化、可(kě)視化,提升産品的可(kě)追溯性,是醫(yī)療器械監管手段創新(xīn)和監管效能(néng)提升的重要抓手,對嚴守醫(yī)療器械安(ān)全底線(xiàn)、助力醫(yī)療器械産業高質(zhì)量發展都将起到積極作(zuò)用(yòng)。因此,我國(guó)醫(yī)療器械唯一标識系統建設工作(zuò)急需開展。
醫(yī)療器械唯一标識是國(guó)際醫(yī)療器械監管領域關注的焦點和熱點,2013年,國(guó)際醫(yī)療器械監管機構論壇(IMDRF)發布醫(yī)療器械唯一标識系統指南。同年,美國(guó)發布醫(yī)療器械唯一标識系統法規,要求利用(yòng)7年時間全面實施醫(yī)療器械唯一标識。2017年,歐盟立法要求實施醫(yī)療器械唯一标識,日本、澳大利亞、阿根廷等國(guó)家也相繼開展相關工作(zuò),全球醫(yī)療器械唯一标識工作(zuò)不斷推進。
2012年,國(guó)務(wù)院印發《“十二五”國(guó)家藥品安(ān)全規劃》,要求“啓動高風險醫(yī)療器械國(guó)家統一編碼工作(zuò)”。2016年,國(guó)務(wù)院印發《“十三五”國(guó)家藥品安(ān)全規劃》,要求“構建醫(yī)療器械編碼體(tǐ)系,制定醫(yī)療器械編碼規則”。2019年,國(guó)務(wù)院辦公廳印發《深化醫(yī)藥衛生體(tǐ)制改革2019年重點工作(zuò)任務(wù)》,要求“制定醫(yī)療器械唯一标識系統規則”,經中央全面深化改革委員會第八次會議審議通過,由國(guó)務(wù)院辦公廳印發的《治理(lǐ)高值醫(yī)用(yòng)耗材改革方案》中,明确提出“制定醫(yī)療器械唯一标識系統規則”。2019年7月,國(guó)家藥監局會同國(guó)家衛生健康委聯合印發《醫(yī)療器械唯一标識系統試點工作(zuò)方案》,拉開我國(guó)醫(yī)療器械唯一标識系統建設序幕。
三、建設醫(yī)療器械唯一标識系統有什麽重要意義? 通過建立醫(yī)療器械唯一标識系統,有利于實現監管數據的整合和共享,創新(xīn)監管模式,提升監管效能(néng),加強醫(yī)療器械全生命周期管理(lǐ),淨化市場、優化營商環境,實現政府監管與社會治理(lǐ)相結合,形成社會共治的局面,助力産業轉型升級和健康發展,為(wèi)公衆提供更加安(ān)全高效的醫(yī)療服務(wù),增強人民(mín)群衆的獲得感。
從産業角度看,對于醫(yī)療器械生産企業,利用(yòng)唯一标識有助于提升企業信息化管理(lǐ)水平,建立産品追溯體(tǐ)系,加強行業自律,提升企業管理(lǐ)效能(néng),助推醫(yī)療器械産業高質(zhì)量發展。對于醫(yī)療器械經營企業,利用(yòng)唯一标識,可(kě)建立符合現代化的物(wù)流體(tǐ)系,實現醫(yī)療器械供應鏈的透明化、可(kě)視化、智能(néng)化。對于醫(yī)療機構,利用(yòng)唯一标識,有利于減少用(yòng)械差錯,提升院内耗材管理(lǐ)水平,維護患者安(ān)全。
從政府管理(lǐ)角度看,對于醫(yī)療器械監管,利用(yòng)唯一标識,可(kě)構建醫(yī)療器械監管大數據,實現對醫(yī)療器械來源可(kě)查、去向可(kě)追、責任可(kě)究,實現智慧監管。對于衛生行政管理(lǐ)部門,利用(yòng)唯一标識,可(kě)強化對醫(yī)療用(yòng)械行為(wèi)的規範化管理(lǐ),推動建立健康醫(yī)療大數據,提高衛生管理(lǐ)效率,助力健康中國(guó)戰略。對于醫(yī)保部門,有助于在采購(gòu)招标中精(jīng)準識别醫(yī)療器械,推動實現結算透明化,打擊欺詐和濫用(yòng)行為(wèi)。
從公衆角度看,通過信息公開和數據共享,讓消費者放心使用(yòng)、明白消費,有效維護消費者合法權益。
四、醫(yī)療器械唯一标識實施遵循哪些原則? 《醫(yī)療器械唯一标識系統規則》(以下簡稱《規則》)要求,唯一标識系統建設應當積極借鑒國(guó)際标準,遵循政府引導、企業落實、統籌推進、分(fēn)布實施的原則。為(wèi)更好地促進國(guó)際交流和國(guó)際貿易,優化營商環境,我國(guó)唯一标識系統建設借鑒了國(guó)際通行的原則和标準。建立唯一标識系統,政府起引導作(zuò)用(yòng),注冊人/備案人作(zuò)為(wèi)第一責任人負責落實,積極應用(yòng)唯一标識提升産品質(zhì)量和企業管理(lǐ)水平。由于醫(yī)療器械的多(duō)樣性和複雜性,分(fēn)步實施唯一标識是國(guó)際通行做法,我國(guó)醫(yī)療器械按照風險等級實行分(fēn)類管理(lǐ),在借鑒國(guó)際唯一标識相關實踐經驗的基礎上,結合我國(guó)醫(yī)療器械産業和監管實際,制定了分(fēn)步實施的政策,相較于美歐,我國(guó)實施唯一标識增加了試點環節,以部分(fēn)高風險植/介入醫(yī)療器械為(wèi)主,覆蓋範圍更小(xiǎo),确保規則穩步推進。
五、如何實現唯一标識數據彙聚和共享? 醫(yī)療器械唯一标識數據彙聚和共享通過醫(yī)療器械唯一标識數據庫實現,該數據庫由國(guó)家藥品監督管理(lǐ)局組織建設,由注冊人/備案人将唯一标識的産品标識及關聯信息按照相關标準和規範上傳至數據庫,并對數據的準确性、唯一性負責。醫(yī)療器械經營企業、醫(yī)療機構、政府相關部門及公衆可(kě)通過數據查詢、下載、數據對接等方式共享唯一标識數據。
六、《規則》施行前已上市産品是否需要賦予唯一标識? 《規則》實施之日起,注冊人/備案人應當在申請相關醫(yī)療器械注冊、注冊變更或者辦理(lǐ)備案時,在注冊/備案管理(lǐ)系統中提交其産品标識。相關醫(yī)療器械産品應當在生産過程中賦予醫(yī)療器械唯一标識,在産品上市銷售前應當完成醫(yī)療器械唯一标識産品标識和相關數據的上傳。
《規則》實施之日前已生産、銷售的醫(yī)療器械可(kě)不具備醫(yī)療器械唯一标識。
七、如何選擇醫(yī)療器械唯一标識數據載體(tǐ)? 當前市面上常用(yòng)的數據載體(tǐ)包括一維碼、二維碼和射頻标簽(RFID)。
一維碼是隻在一維方向上表示信息的條碼符号,應用(yòng)多(duō)年已經很(hěn)成熟,成本低,能(néng)很(hěn)好兼容市面上現有的掃碼設備,但一維碼所占空間大,破損糾錯能(néng)力差。
二維碼是在二維方向上都表示信息的條碼符号,相比于一維碼,相同空間能(néng)夠容納更多(duō)的數據,在器械包裝(zhuāng)尺寸受限的時候能(néng)發揮很(hěn)好的作(zuò)用(yòng),具備一定的糾錯能(néng)力,但對識讀設備的要求相較于一維碼要高。
射頻标簽具有信息存儲功能(néng),能(néng)接收讀寫器的電(diàn)磁調制信号,并返回相應信号的數據載體(tǐ)。射頻标簽的載體(tǐ)成本和識讀設備成本相較于一維碼和二維碼要高,但RFID讀取速度快,可(kě)以實現批量讀取,在某些環節和領域能(néng)夠發揮作(zuò)用(yòng)。
注冊人/備案人可(kě)根據産品的特征、價值、主要應用(yòng)場景等因素選擇适當的醫(yī)療器械唯一标識數據載體(tǐ)。
八、發碼機構需要具備什麽樣的資質(zhì),其職責和義務(wù)有哪些? 器械唯一标識的發碼機構應當為(wèi)中國(guó)境内的法人機構,具備完善的管理(lǐ)制度和運行體(tǐ)系,确保按照其标準創建的醫(yī)療器械唯一标識的唯一性,并符合我國(guó)數據安(ān)全有關要求。
發碼機構應當向注冊人/備案人提供執行其标準的流程并指導實施,為(wèi)便于注冊人/備案人等掌握發碼機構的編碼标準,供相關方選擇或應用(yòng),發碼機構應當将其編碼标準上傳至醫(yī)療器械唯一标識數據庫并動态維護。每年1月31日前,發碼機構應當向國(guó)家藥品監督管理(lǐ)局提交按照其标準創建的唯一标識上一年度的報告。
九、注冊人/備案人實施唯一标識的流程是什麽? 注冊人/備案人實施唯一标識的流程為(wèi):
第一步:注冊人/備案人按照《規則》和相關标準,結合企業實際情況選擇發碼機構。
第二步:注冊人/備案人按照發碼機構的标準創建産品标識,并确定該産品生産标識的組成。
第三步:《規則》實施之日起,申請醫(yī)療器械注冊、注冊變更或者辦理(lǐ)備案的,注冊人/備案人應當在注冊/備案管理(lǐ)系統中提交産品标識。
第四步:注冊人/備案人根據發碼機構标準選擇适當的數據載體(tǐ),對醫(yī)療器械最小(xiǎo)銷售單元和更高級别的包裝(zhuāng)或醫(yī)療器械産品上賦予醫(yī)療器械唯一标識數據載體(tǐ)。
第五步:注冊人/備案人在産品上市銷售前将産品标識和相關信息上傳至醫(yī)療器械唯一标識數據庫。
第六步:産品标識及數據相關信息變化時,注冊人/備案人及時更新(xīn)醫(yī)療器械唯一标識數據庫。

掃二維碼用(yòng)手機看
江西醫(yī)為(wèi)特科(kē)技(jì )有限公司
醫(yī)為(wèi)特科(kē)技(jì )未來将在泌尿外科(kē)領域持續投入研發力量,緻力于為(wèi)全球泌尿外科(kē)結石患者提供更好的醫(yī)療器械服務(wù)。
版權所有:© 2020 江西醫(yī)為(wèi)特科(kē)技(jì )有限公司 京ICP證000000号 此網站支持ipv4 ipv6雙向訪問! 技(jì )術支持:中企動力-南昌


